작가:
Lewis Jackson
창조 날짜:
8 할 수있다 2021
업데이트 날짜:
25 6 월 2024

콘텐츠
순 이온 방정식은 화학 반응에서 변화하는 입자만을 나타 내기 때문에 화학에서 중요한 부분입니다. 그들은 산화-환원 반응, 대사 반응 및 산-염기의 중화 반응에 가장 일반적으로 사용됩니다. 순 이온 방정식을 작성하는 데는 세 가지 기본 단계가 있습니다. 분자 방정식의 균형을 맞추고 (각 물질이 용액에 어떻게 존재하는지에 따라) 전체 이온 방정식으로 변환하고, 마지막으로 순 이온 방정식을 작성합니다.
단계
2 단계 중 1 : 이온 방정식의 구성 요소 이해
분자의 차이점을 알고 이온 화합물. 순 이온 방정식을 작성하는 첫 번째 단계는 반응에서 이온 화합물을 결정하는 것입니다. 이온 화합물은 수용액에서 이온을 해리하고 전하를 띠는 화합물입니다. 분자 화합물은 전하가 전혀없는 화합물입니다. 이들은 두 비금속 사이에 형성되며 때때로 공유 화합물이라고도합니다.
- 이온 화합물은 금속과 비금속, 금속과 다 원자 이온 또는 다중 다 원자 이온 사이에 형성 될 수 있습니다.
- 화합물이 무엇인지 확실하지 않은 경우 주기율표에서 해당 화합물의 원소를 찾을 수 있습니다.

화합물의 용해도를 인식합니다. 모든 이온 화합물이 수용액에 용해되는 것은 아니므로 이온으로 해리 될 수 없습니다. 나머지 방정식을 진행하기 전에 각 화합물의 용해도를 확인해야합니다. 다음은 용해도 규칙을 요약 한 것입니다. 이러한 규칙에 대한 자세한 정보와 예외 사항은 용해도 스프레드 시트를 참조하십시오.- 아래에 설명 된 순서대로 다음 규칙을 따르십시오.
- 모든 Na, K 및 NH 염4 모두 녹습니다.
- 모든 NO 염3, 씨2H3영형2, ClO3및 ClO4 모두 녹습니다.
- 모든 Ag, Pb 및 Hg 염2 모두 녹습니다.
- 모든 Cl, Br 및 I 염은 용해됩니다.
- 모든 CO 염3, O, S, OH, PO4, CrO4, Cr2영형7, 그리고 SO3 용해됩니다 (몇몇 경우 제외).
- 모든 SO 염4 용해됩니다 (몇몇 경우 제외).
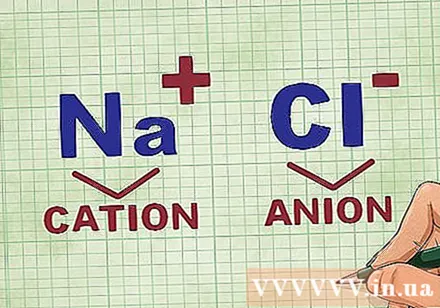
화합물의 양이온 및 음이온 측정. 양이온은 화합물의 양이온이며 일반적으로 금속입니다. 음이온은 화합물의 음이온이며 비금속입니다. 일부 비금속은 양이온을 형성 할 수 있지만 금속은 항상 양이온을 형성합니다.- 예를 들어, NaCl에서 Na는 금속이기 때문에 양으로 하전 된 양이온이고 Cl은 비금속이기 때문에 음으로 하전 된 음이온입니다.

반응에서 다 원자 이온을 인식합니다. 다 원자 이온은 서로 단단히 결합되어 화학 반응 중에 해리되지 않는 하전 된 분자입니다. 다 원자 이온은 특정 전하를 가지고 있고 해리되지 않기 때문에 인식하는 것이 중요합니다. 다 원자 이온은 양전하 또는 음전하를 가질 수 있습니다.- 일반 화학을 공부하는 경우 일반적인 다 원자 이온을 기억해야하는 경우가 많습니다.
- 일반적인 다 원자 이온은 CO입니다.3, 아니3, 아니2, 그래서4, 그래서3, ClO4 및 ClO3.
- 화학 서적이나 인터넷에서 다른 많은 이온을 찾을 수도 있습니다.
2/2 부 : 순 이온 방정식 작성
분자 방정식의 균형. 순 이온 방정식을 작성하기 전에 분자 방정식이 균형을 이루는 지 확인해야합니다. 방정식의 균형을 맞추기 위해 화합물 앞에 계수를 추가하여 각 요소의 원자 번호가 방정식의 양쪽에서 동일하도록합니다.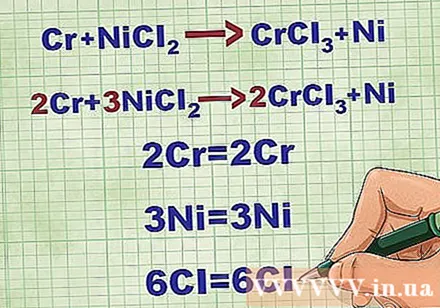
- 방정식의 양쪽에 각 화합물을 구성하는 원자의 수를 씁니다.
- 산소와 수소 이외의 원소 앞에 계수를 추가하여 양쪽의 균형을 맞 춥니 다.
- 수소 원자 균형.
- 산소 원자 균형.
- 방정식의 각 변에있는 원자의 수를 다시 계산하여 균형이 맞는지 확인하십시오.
- 예를 들어 Cr + NiCl2 -> CrCl3 + Ni 2Cr + 3NiCl로 균형2 -> 2CrCl3 + 3Ni.
방정식에서 화합물의 상태를 확인하십시오. 문제에는 여러 번 각 화합물의 상태를 알려주는 키워드가 있습니다. 요소 또는 화합물의 상태를 결정하는 데 도움이되는 몇 가지 규칙이 있습니다.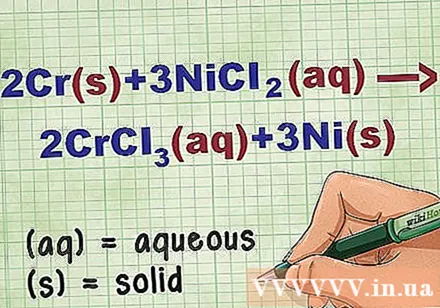
- 요소의 상태가 제공되지 않으면 주기율표에있는 상태를 사용하십시오.
- 화합물을 용액이라고 부르면 수용액 또는 (dd).
- 방정식에 물이있는 경우 용해도 스프레드 시트를 사용하여 이온 화합물이 수용성인지 확인해야합니다. 용해도가 높으면 화합물은 수성 (dd), 용해도가 낮 으면 화합물이 고체가됩니다 (아르 자형).
- 물이 없으면 이온 화합물은 고체입니다 (아르 자형).
- 문제가 산성이거나 염기성 인 경우 화합물은 수성입니다 (dd).
- 예를 들어, 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. Cr 및 Ni의 원소 형태는 고체 상태입니다. NiCl2 및 CrCl3 이온 화합물은 수용성이므로 수용성입니다. 방정식을 다음과 같이 다시 작성하십시오. 2Cr(아르 자형) + 3NiCl2(dd) -> 2CrCl3(dd) + 3Ni(아르 자형).
용액에서 어떤 화합물이 해리 (양이온과 음이온으로 해리)되는지 결정합니다. 물질이나 화합물이 해리되면 양전하를 띤 이온 (양이온)과 음전하를 띤 이온 (음이온)으로 해리됩니다. 이들은 순 이온 방정식의 끝에서 평형을 이룰 구성 요소입니다.
- 고체, 액체, 기체, 분자 화합물, 낮은 용해도 이온 화합물, 다 원자 이온 및 약산은 해리되지 않습니다.
- 이온 화합물은 용해도가 높고 (용해도 표 사용) 강산은 100 % 이온화됩니다 (HCl(dd), HBr(dd), 안녕하세요(dd), H2그래서4(dd), HClO4(dd)및 HNO3(dd)).
- 다 원자 이온은 더 이상 해리되지 않지만 해당 화합물의 구성 요소 인 경우 화합물에서 해리됩니다.
화합물에서 분리 된 각 이온의 전하를 계산합니다. 금속은 양이온을 형성하고 비금속은 음이온을 형성한다는 것을 기억하십시오. 주기율표를 사용하여 원소의 전하를 결정하십시오. 또한 화합물의 각 이온 전하의 균형을 맞춰야합니다.
- 이 예에서 NiCl2 CrCl 동안 Ni와 Cl로 해리3 Cr과 Cl로 분할됩니다.
- Cl은 1의 음전하를 갖지만 2 개의 원자를 가지고 있기 때문에 Ni는 2+의 전하를 갖습니다. 따라서 우리는 2 개의 음이온의 Cl 이온의 균형을 맞춰야합니다. Cr은 3+ 전하를 가지므로 3 개의 음이온 Cl 이온의 균형을 맞춰야합니다.
- 다 원자 이온에는 특정 전하가 있음을 기억하십시오.
완전한 이온 방정식을 기록하십시오. 해리되거나 이온화되는 (강산) 모든 것은 두 개의 개별 이온으로 분리됩니다. 물질의 상태는 남아 있습니다 (dd), 방정식이 균형을 유지하는지 확인하십시오.
- 고체, 액체, 기체, 약산 및 낮은 용해도 이온 화합물은 상태를 변경하거나 이온으로 분리되지 않습니다. 우리는 그것들을 그대로 유지합니다.
- 분자 물질은 용액에 분산되어 상태가 (dd). 세 가지 예외 아니다 (dd)는 CH4(케이), 씨3H8(케이), 및 C8H18(엘).
- 위의 예를 계속하면 전체 이온 방정식은 다음과 같습니다. 2Cr(아르 자형) + 3Ni(dd) + 6Cl(dd) -> 2Cr(dd) + 6Cl(dd) + 3Ni(아르 자형). Cl이 화합물에 없으면 양극성이 아니므로 계수에 화합물의 원자 수를 곱하여 방정식의 양쪽에 6 개의 Cl 이온을 얻습니다.
방정식의 각 변에서 동일한 이온을 제거하여 평형 이온을 제거합니다. 양측 (충전, 원자 번호 등)이 똑같은 경우에만 취소 할 수 있습니다. 파괴 가능한 물질없이 방정식을 다시 작성하십시오.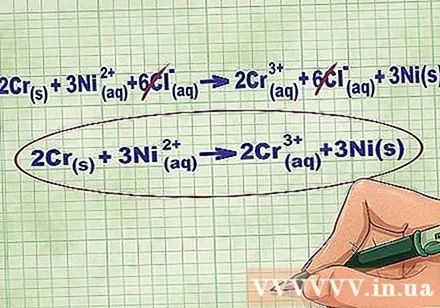
- 예제를 완료 한 후 각면에 6 개의 취소 가능한 Cl 평형 이온이 있습니다. 순 이온 방정식은 2Cr입니다.(아르 자형) + 3Ni(dd) -> 2Cr(dd) + 3Ni(아르 자형).
- 맞다면 반응물 쪽의 총 전하가 순 이온 방정식에서 생성물 쪽의 총 전하와 같아야합니다.
조언
- 방정식에있는 모든 물질의 상태를 기록하십시오. 의지 포인트를 잃습니다.